مرفق الخدمات الخاصة
في هذا العدد من المجلة البحثية، سنسلط الضوء على البحث الذي يجريه مرفق الخدمات الخاصة في معهد دسمان للسكري، بقيادة الدكتور محمد أبو فرحة.
أبرز نتائج الأبحاث
تعرف على آخر الأبحاث التي يجريها معهد دسمان للسكري باستخدام خطط التنميط الجيني لتعدد أشكال النوكليوتيد المفردة
يزيد FTO SNP RS1421085 من وزن الجسم والكتلة من دون دهون ومياه الجسم الكلية عن طريق التفاعل مع بروتينات الجريلين والبروتينات الدهنية.
تاريخ النشر19/10/2019
Prashantha Hebbar@, Mohamed Abu-Farha@, Anwar Mohammad, Fadi Alkayal, Motasem Melhem, Jehad Abubaker, Fahd Al-Mulla, Thangavel Alphonse Thanaraj*
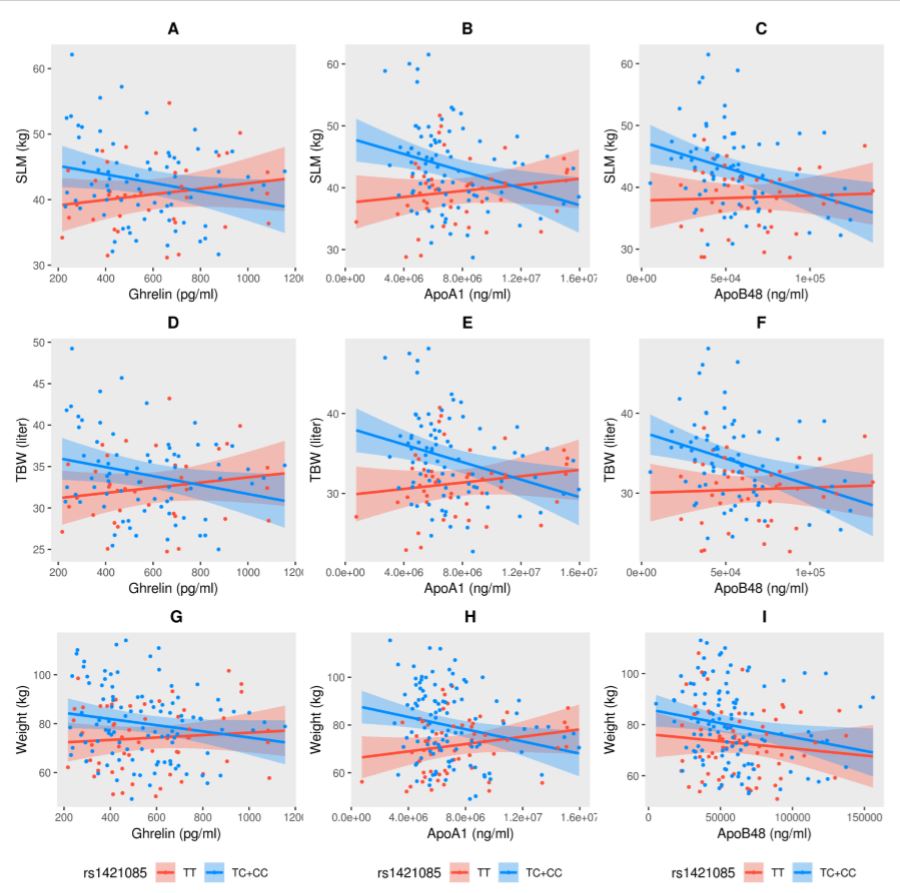
كتطبيق لخطط التنميط الجيني المتعلق بتعدد أشكال النوكليوتيد المفردة، تم إعداد المنشور التالي وتقديمه للنشر. شهدت حقبة ما بعد النفط في دول الخليج ارتفاعاً متزايداً وسريعاً للسمنة في المنطقة، ما جعل دول مجلس التعاون الخليجي في المرتبة الأولى عالمياً من حيث إحصاءات السمنة لدى البالغين. على الرغم من ارتفاع معدلات السمنة في المنطقة، لم يشتمل السكان العرب في الدراسات الوراثية العالمية المتعلّقة بالسمنة. إن الجين المرتبط بالكتلة الدهنية والسمنة (FTO) تم إثبات الاشتباه بعلاقته بالإصابة بالسمنة لدى الأوروبيين، ثم لدى الأفارقة وشعوب جنوب وشرق آسيا وغيرهم من الشعوب. على الرغم من وجود عدد كبير من دراسات الارتباط الجيني المتعلقة بالسمنة والكتلة الدهنية، إلا أن تفاصيل الآلية لتأثير الاختلافات الجينية المحددة غير متوفرة بشكل عام. تدعو الحاجة إلى مناهج جديدة لتحديد تأثير المتغيرات الجينية على مسببات السمنة. ويمكن التوصّل إليها من خلال التنميط الظاهري المعمّق للمؤشرات الحيوية المعروف أنها معنيّة بالعمليات البيولوجية ذات الصلة، ودراسة هذه المتغيرات الجينية ضمن مجموعات مختلفة. أجرينا مؤخرًا دراسة قيّمنا ضمنها تأثير متغير FTO rs1421085 على مختلف مقاييس الجسم البشري والسمنة والمؤشرات الحيوية للالتهابات والقلب والأوعية الدموية في مجموعة من المشاركين العرب في الكويت. وتم اختيار rs1421085 نظراً إلى أنه لوحظ ارتباطه بمختلف سمات القياسات البشرية المتعلقة بالسمنة في مجموعات سكانية أخرى مختلفة. وجدنا أن rs1421085_C SNP يرتبط بمستويات أعلى من وزن الجسم والكتلة من دون دهون (SLM) وإجمالي مياه الجسم (TBW). تم أخذ قياسات هذه الصفات الثلاث عن طريق التفاعل بين الأنماط الجينية (TC + CC) التي تحتوي على أليل التأثير ومقاييس المؤشرات الحيوية الأيضية. وهكذا أظهر الأفراد المصابون بالأنماط الجينية TC + CC ارتفاعاً في وزن الجسم وكتلة الجسم (SLM) وإجمالي مياه الجسم، مع انخفاض مصاحب في مستويات Ghrelin و ApoA1 و ApoB48 (الرسم البياني 4). في حين تم الإبلاغ عن الارتباط بين السمنة وكتلة الدهون والجريلين سابقًا، إننا نبلّغ ولأول مرة، على حد علمنا، عن وجود ارتباطات بين السمنة وكتلة الدهون وApoA1 وApoB48. وبطريقة مماثلة، إن ارتباط السمنة وكتلة الدهون بمياه الجسم الكلية والكتلة الخالية من الدهون، هو على عكس سمات السمنة الأخرى (مثل مؤشر كتلة الجسم ومحيط الخصر) غير شائع في المنشورات.
المراجع:
Dina, C., D. Meyre, S. Gallina, E. Durand, A. Korner, P. Jacobson, L. M. Carlsson, W. Kiess, V. Vatin, C. Lecoeur, J. Delplanque, E. Vaillant, F. Pattou, J. Ruiz, J. Weill, C. Levy-Marchal, F. Horber, N. Potoczna, S. Hercberg, C. Le Stunff, P. Bougneres, P. Kovacs, M. Marre, B. Balkau, S. Cauchi, J. C. Chevre and P. Froguel (2007). “Variation in FTO contributes to childhood obesity and severe adult obesity.” Nat Genet 39(6): 724-726.
Frayling, T. M., N. J. Timpson, M. N. Weedon, E. Zeggini, R. M. Freathy, C. M. Lindgren, J. R. Perry, K. S. Elliott, H. Lango, N. W. Rayner, B. Shields, L. W. Harries, J. C. Barrett, S. Ellard, C. J. Groves, B. Knight, A. M. Patch, A. R. Ness, S. Ebrahim, D. A. Lawlor, S. M. Ring, Y. Ben-Shlomo, M. R. Jarvelin, U. Sovio, A. J. Bennett, D. Melzer, L. Ferrucci, R. J. Loos, I. Barroso, N. J. Wareham, F. Karpe, K. R. Owen, L. R. Cardon, M. Walker, G. A. Hitman, C. N. Palmer, A. S. Doney, A. D. Morris, G. D. Smith, A. T. Hattersley and M. I. McCarthy (2007). “A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity.” Science 316(5826): 889-894.
Hertel, J. K., S. Johansson, E. Sonestedt, A. Jonsson, R. T. Lie, C. G. Platou, P. M. Nilsson, G. Rukh, K. Midthjell, K. Hveem, O. Melander, L. Groop, V. Lyssenko, A. Molven, M. Orho-Melander and P. R. Njolstad (2011). “FTO, type 2 diabetes, and weight gain throughout adult life: a meta-analysis of 41,504 subjects from the Scandinavian HUNT, MDC, and MPP studies.” Diabetes 60(5): 1637-1644.
Li, H., T. O. Kilpelainen, C. Liu, J. Zhu, Y. Liu, C. Hu, Z. Yang, W. Zhang, W. Bao, S. Cha, Y. Wu, T. Yang, A. Sekine, B. Y. Choi, C. S. Yajnik, D. Zhou, F. Takeuchi, K. Yamamoto, J. C. Chan, K. R. Mani, L. F. Been, M. Imamura, E. Nakashima, N. Lee, T. Fujisawa, S. Karasawa, W. Wen, C. V. Joglekar, W. Lu, Y. Chang, Y. Xiang, Y. Gao, S. Liu, Y. Song, S. H. Kwak, H. D. Shin, K. S. Park, C. H. Fall, J. Y. Kim, P. C. Sham, K. S. Lam, W. Zheng, X. Shu, H. Deng, H. Ikegami, G. V. Krishnaveni, D. K. Sanghera, L. Chuang, L. Liu, R. Hu, Y. Kim, M. Daimon, K. Hotta, W. Jia, J. S. Kooner, J. C. Chambers, G. R. Chandak, R. C. Ma, S. Maeda, R. Dorajoo, M. Yokota, R. Takayanagi, N. Kato, X. Lin and R. J. Loos (2012). “Association of genetic variation in FTO with risk of obesity and type 2 diabetes with data from 96,551 East and South Asians.” Diabetologia 55(4): 981-995.
Loos, R. J. and G. S. Yeo (2014). “The bigger picture of FTO: the first GWAS-identified obesity gene.” Nat Rev Endocrinol 10(1): 51-61. Wu, C. and P. Arora (2016). “Noncoding Genome-Wide Association Studies Variant for Obesity: Inroads Into Mechanism: An Overview From the AHA’s Council on Functional Genomics and Translational Biology.” J Am Heart Assoc 5(7).


